English version is here.
このページへリンクを張る際は,
Amazon.co.jp ウィジェット
ホーム > なんごろく > なんごろく−感染症 >
なんごろく−感染症 インフルエンザに対するゾフルーザ(R)(バロキサビル)の効果
Hayden FG, Sugaya N, Hirotsu N, Lee N, de Jong MD, Hurt AC, Ishida T, Sekino
H, Yamada K, Portsmouth S, Kawaguchi K, Shishido T, Arai M, Tsuchiya K,
Uehara T, Watanabe A; Baloxavir Marboxil Investigators Group.PubMed PMID: 30184455.
批判的吟味日時:2018年11月14日,2019年2月11日更新チェックシート は はじめてトライアルシート6.2
カテゴリー: 治療 資金源: 利益相反: 1.論文のPICO: Phase 2 trial P: 除外基準: I/C: Phase 3 trial P: I/C: O: アセトアミノフェンは使ってもよい.
2.ランダム割付けされているか?: 3.Baselineは同等か?: バロキサビル群に有利な分布になっている 4-1.ITT解析か?: 4-2.結果に影響を及ぼすほどの脱落があるか?: 5.マスキング(盲検化)されているか?: 6.症例数は十分か?: 7.結果の評価: 7-1.インフルエンザ症状改善効果
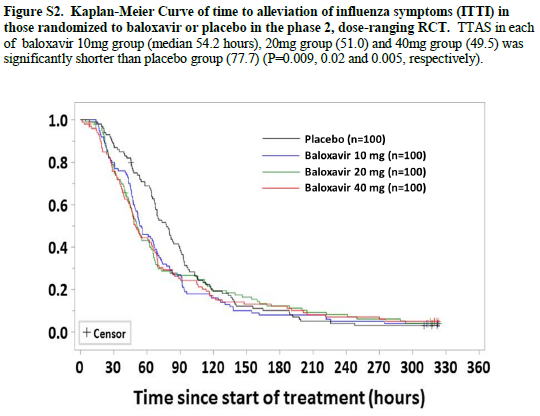
Phase 2 trialのインフルエンザ症状の改善効果の結果はSupplementary AppendixのFigure S2にある.バロキサビルはプラセボと比較して有意に中央値1日ほど早く症状を改善させるが,10 mgでも,20 mgでも40 mgでもほぼ同じである.
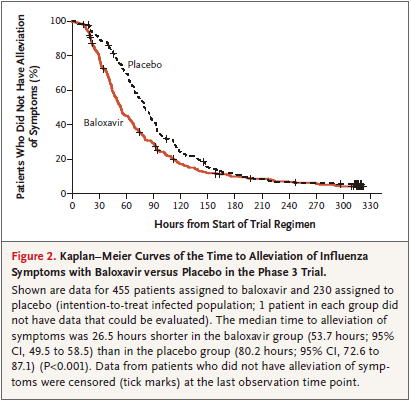
Phase 3 trialの結果では,バロキサビルはプラセボと比較して,26.5時間(53.7時間 vs 80.2時間)早く治した
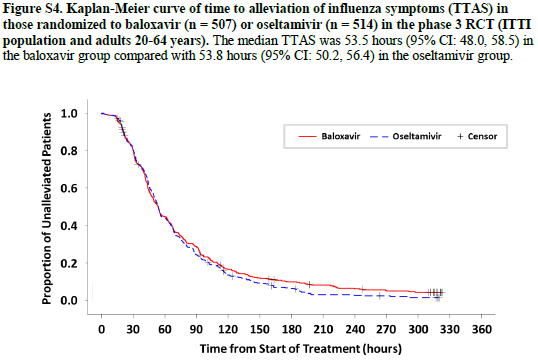
オセルタミビルとの比較では,効果はほぼ変わらないが,120時間(5日目)以降,バロキサビル群の治りが悪くなっているように見える
7-2.ウイルス力価に対する効果
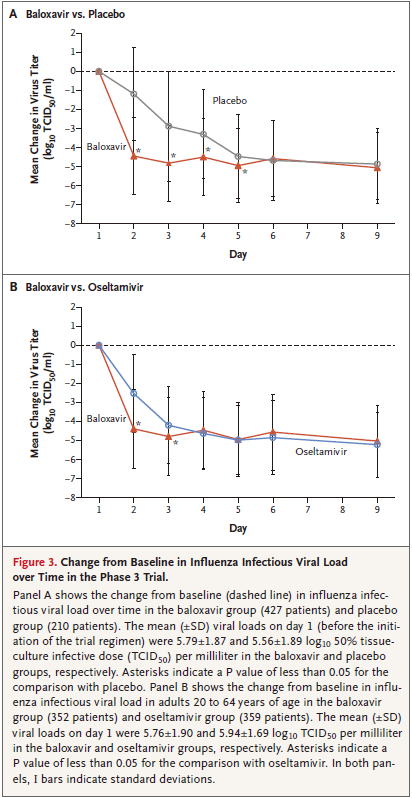
ウイルス力価は,オセルタミビルと比較してバロキサビルは2日目と3日目のウイルス抗体価が低いが,それ以外では変わらない
7-3.Secondary clinical end pointsについての効果
Secondary clinical end pointsの結果については以下の通りである.
バロキサビル群 プラセボ群 オセルタミビル群 p値
解熱までの時間 24.5時間 42.0時間 <0.001
通常の健康状態に戻るまでの時間 129.2時間 168.8時間 0.06
抗菌薬治療を要した合併症 2.5% 4.3% 2.4% −
解熱までの時間と通常の健康状態に戻るまでの時間について,バロキサビル群とオセルタミビル群の比較結果が欲しいところだが,データは示されていない.
7-4.解析人数についてのまとめ
本研究は多様な解析をしているので,理解が難しい.難しい理由は,インフルエンザに罹患している患者と罹患していない患者が混じっていること,オセルタミビルは12〜19歳では使用されていないので,20〜64歳だけ取り出した解析があるからである.ここに,各解析の解析人数をまとめる.
図表番号 内容 バロキサビル群 プラセボ群 オセルタミビル群 備考
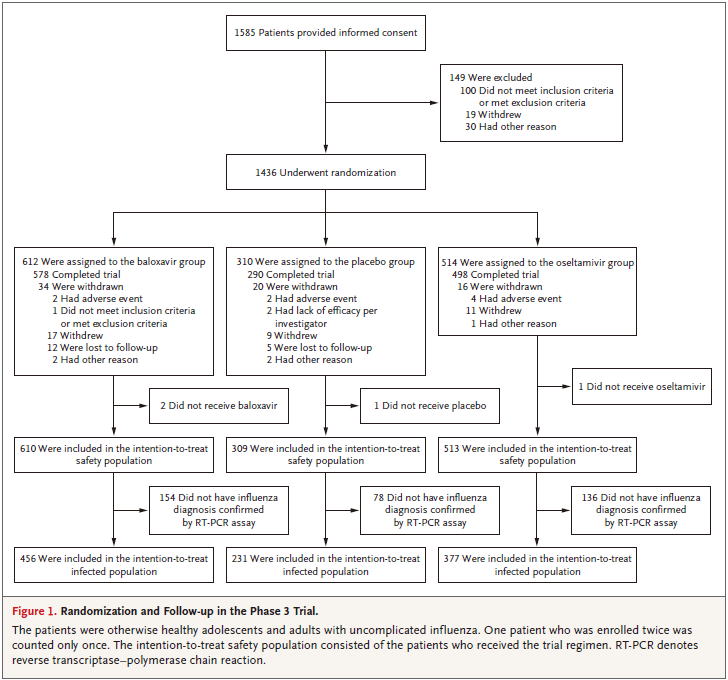
Figure 1 A Baseline比較:合計 612 310 514
B ITT safety population* 610 309 513 =Table 2
C ITT infected population* 456 231 377
D インフルエンザにかかっていない患者(A-C) 156 79 137
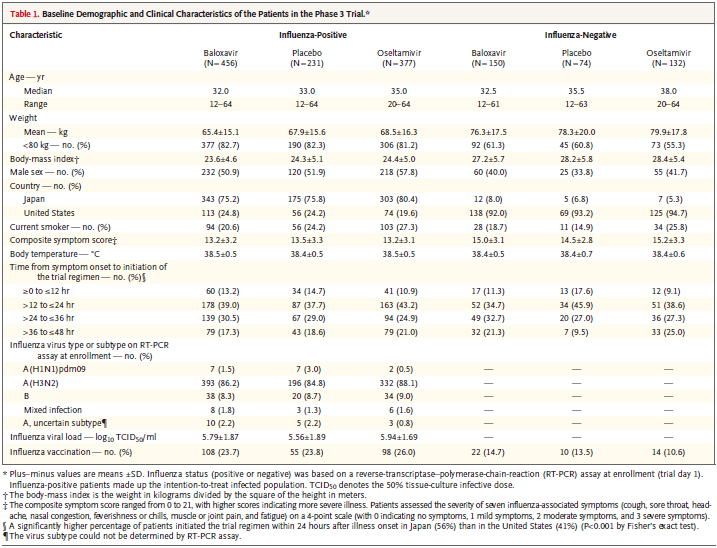
Table 1 Baseline比較:Influenza-Positive 456 231 377 Cと同じ
Baseline比較:Influenza-Negative 150 74 132 Dと違う!?
Figure 2 TTAS**=primary outcome(バロキサビル vs プラセボ) 455 230 Cより各群1名ずつ少ない?
Figure 3A IIVLT(バロキサビル vs プラセボ)*** 427 210
Figure 3B IIVLT(バロキサビル vs オセルタミビル)*** 352 359 20〜64歳
Table S2 Baseline比較,20〜64歳 376 377 Cのうち20〜64歳だけ取り出した
Figure S4 TTAS=primary outcome(バロキサビル vs オセルタミビル),20〜64歳 507 514 インフルエンザに罹患していない患者も含まれている
Figure S5A Influenza virus RNA loads(バロキサビル vs プラセボ) 456 231 Cと同じ
Figure S5B Influenza virus RNA loads(バロキサビル vs オセルタミビル) 376 377 Cのうち20〜64歳だけ取り出した
Figure S6A Time to cessation of infectious virus detections(バロキサビル vs プラセボ) 426 209 Cから症例が減っている
Figure S6B Time to cessation of infectious virus detections(バロキサビル vs オセルタミビル) 351 357 Cから症例が減っている
*ITT: Intention-to-treat
7-5.薬剤耐性を示す変異ウイルスの発生について
活性エンドヌクレアーゼ部位(I38T/F)の特定のアミノ酸置換(ポリメラーゼ酸性蛋白PA変異)は,細胞培養における代表的なインフルエンザAウイルスのバロキサビルに対する感受性を11〜57倍低下させるとされている.Phase 2 trialのバロキサビル群の患者(すべてインフルエンザA(H1N1)pdm09感染)の2.2 %およびPhase 3 trialの患者(すべてインフルエンザA(H3N2)感染)の9.7
%で,バロキサビルに対する感受性の低下をもたらすI38T/M/F置換を有する変異型ウイルスが検出された. 変異型の場合にバロキサビルを使用してもウイルスが高率に残存した I38T/M変異があるとない場合と比較して症状消失までの時間が長かった(63.1時間 vs 49.6時間)
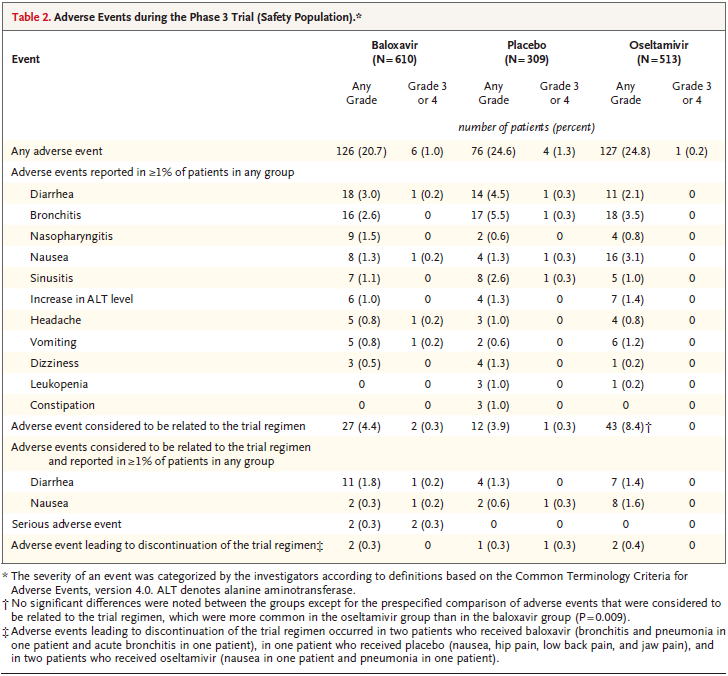
7-6.副作用について
副作用についてはTable 2にある.オセルタミビルは過去の研究では1割程度に嘔気や嘔吐が出ているが,本研究のPhase 3 trialでは,わずか1.6
%しか発生していない.バロキサビルでは,嘔気は0.3 %しかない.薬剤によると思われる副作用はプラセボ群0.3 %に対して,バロキサビル群で0.3
%,オセルタミビル群で8.4 %と,バロキサビルはプラセボと同等の薬剤関連有害事象発生率となっている.しかし,有害事象全体の発症率では,プラセボ群が24.6 %に対して,バロキサビル群が20.7 %,オセルタミビル群が24.8 %となっており,プラセボを使用したほうがバロキサビルを使用するよりも有害事象が多いという奇異な現象が起こっている
7-7.B型インフルエンザについて
本研究におけるB型インフルエンザ患者は8〜9%程度しかいない.そのため,B型インフルエンザに対する効果は不明である.しかし,製薬会社のパンフレットには,ウイルス型別のウイルス放出抑制作用についての表があり,バロキサビルはオセルタミビル同様にA型と比較してB型のほうがウイルス力価が高くなっている.これは,オセルタミビルと同様にバロキサビルもB型インフルエンザには有効性がA型に劣ることが考えられる
季節性インフルエンザウイルスに対する増殖抑制作用(in vitro)90 )
型/亜型 株 バロキサビル オセルタミビル
A/H1N1 A/WSN/33 0.79±0.13 161.12±186.18
A/H1N1 A/WSN/33-NA/H274Y 0.46±0.14 >400
A/H1N1 A/PR/8/34 0.79±0.12 180.50±73.86
A/H3N2 A/Victoria/3/75 0.98±0.20 64.61±44.97
A/H3N2 A/Hong Kong/8/68 0.64±0.30 44.15±25.68
B B/Maryland/1/59 3.08±1.16 245.75±165.74
B B/Hong Kong/5/72 2.21±0.65 537.50±211.21
B B/Lee/40 3.40±1.27 371.77±152.75
方法:5株のA型及び3株のB型インフルエンザウイルス実験室株をMDCK細胞に感染させ,種々の濃度の化合物存在下で培養し,翌日(A型およびB型ウイルスの培養期間はそれぞれ24及び30時間)の培養上清中に放出されたウイルス力価(50%組織培養感染量:TCID50 )を測定した.化合物非存在下の条件に比べ,力価を1/10に抑制するために必要な各薬剤の濃度をEC90 として算出した
結局のところ,この治療法は使えるのか:
本研究はリスクの高くない患者に対してバロキサビルを使用するとウイルス力価が治療後2〜3日にオセルタミビルより下がるが,症状の改善までの期間は変えず,むしろ,120時間(5日目)後の以降は,バロキサビル群の治りが悪くなっているのではないかと疑われる
(Phase 3 trial)
インフルエンザ様症状を呈する患者が組み入れられ,解析時にrtPCR陽性患者だけに限定して解析をしているため,両群の背景因子のバランスが崩れている(Phase
3 trial)
バロキサビルの効果は投与量と無関係である(Phase 2 trial)
耐性ウイルスの発現率が高く,その場合バロキサビル投与によってもウイルス力価が下がらず症状が遷延する(Phase 3 trial)
プラセボ群のほうがバロキサビル群よりも有害事象発現率が高いという奇異な現象が起こっている(Phase 3 trial)
インフルエンザ様症状を呈する患者を組み入れて,解析時にインフルエンザに罹患した患者を選んでいるので,患者の背景因子がバロキサビル群のほうに有利に分布している(Phase
3 trial)
糖尿病や喘息,脳卒中を持つ患者や妊婦などは治療対象に含まれない.すなわちこれらハイリスクの患者では,バロキサビルの効果は本研究からは不明である(Phase
2 trial,Phase 3 trial)
B型インフルエンザにはオセルタミビル同様効果が弱い可能性がある
半減期が長く,1回服用で効果が持続するため,服薬アドヒアランスの向上が見込める一方,副作用発現時には休薬する手立てがなく,症状が遷延すると考えられる
以上より,バロキサビルはオセルタミビルよりも優れるとは言えず,むしろ劣っている可能性がある. こちら .一般的な見解についてはこちら .
コメント:
※上記の内容について,ご意見のある方は,是非こちら までお寄せ下さい.ご了解が得られれば,ご意見をコメント欄に掲載させていただきます(匿名可).ご連絡 をお願いいたします.
Copyrights(c)2004- Eishu NANGO